PROPIEDADES PERIÓDICAS.
VÍDEO: LA QUÍMICA Y LA VIDA DIARIA.
!Hola¡ Para valorar los aportes de la química en la vida cotidiana, está bueno el ejercicio de pensar como sería nuestras vidas sin los aportes realizados por ésta ciencia. Para facilitar éste ejercicio los invito a ver el siguiente vídeo y posteriormente comentarlo en clase.
Renunciar a la química, es renunciar a todo. Exitos.
GEOMETRIA MOLECULAR Y FUERZAS INTERMOLECULARES
PROPIEDADES PERIÓDICAS.
¡Hola!
NÚMEROS CUÁNTICOS.
¡Hola!
Comparto con ustedes un vídeo que explica en forma clara y concreta el tema referente a Números cuánticos. Analízalo, desarrolla tus competencias y prepárate para el parcial en la fecha estipulada por tu profesor en clase. A estudiar.
DIAGRAMA DE FASE Y CURVA DE CALENTAMIENTO DEL AGUA.
¡Hola!
Para reforzar el estudio de los temas anteriormente descrito, los invito acceder a la web CAMBIOS DE ESTADO-DIAGRAMAS DE CALENTAMIENTO-DIAGRAMAS DE FASES.
Revisa su contenido y prepárate para el parcial en el tiempo estipulado por tu profesor.
Ir al enlace:http://corinto.pucp.edu.pe/quimicageneral/contenido/56-cambios-de-estado-diagramas-de-calentamiento-diagramas-de-fase.html
Desarrolla tus competencias. A trabajar
VÍDEO: DIAGRAMA DE FASE
Comparto con ustedes éste vídeo correspondiente al diagrama de fase del agua. Analízalo para que afiance tus conocimientos sobre el tema y te prepares para el parcial correspondiente. Adelante confió en ustedes.
CURVA DE CALENTAMIENTO DEL AGUA.
Hola!
Les recomiendo esta página web donde encontrarás la explicación sobre la curva de calentamiento del agua. Analiza e interpreta la gráfica para afianzar tus conocimientos sobre el tema.
Ir a la web: Que es curva de calentamiento del agua?
http://www.conceptodefinición.de/curva-de-calentamiento-del-agua/
Afianza tus competencias. A trabajar
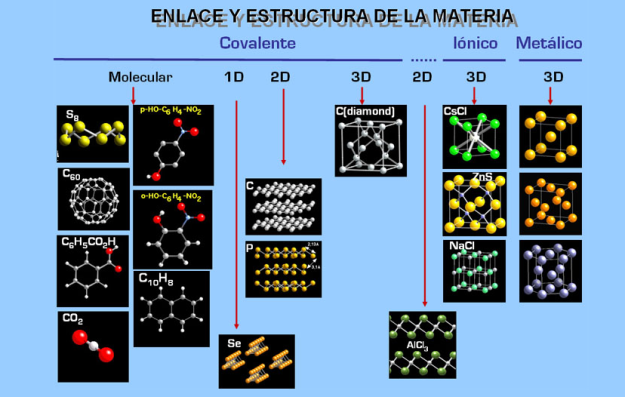
Enlace y estructura de la materia-
-----------------------------------------------------------
---------------------------------------------------------------------------------------------
TALLER DE APLICACIÓN: PROPIEDADES DE LA MATERIA.
1. De las siguientes propiedades del
etanol, indica cuales son físicas y cuáles químicas:
o densidad 0,79 g/cm3
o es inflamable
o no conduce la corriente eléctrica.
o se evapora fácilmente.
2. Clasifica los siguientes fenómenos
según sean cambios físicos o químicos:
v La rotura de un vidrio.
v Asar un pedazo de carne.
v La digestión de los alimentos.
v El hierro metálico se funde.
v La fotosíntesis.
v La dilatación del mercurio.
v La evaporación del agua.
v Disolución de un alka – seltzer
v Hervir leche.
v Un helado expuesto al sol.
3. Determina la densidad de una barra de
hierro cuya masa es de 1,6 x 102 g y su volumen de 20,35 cm3.
4. Cuál es la masa de 40 cm3
de etanol si su densidad es de 0,79 g/cm3.
5. Si el radio de la tierra es de 4,54 x
1025 metros y su masa es de 3,12 x 1029 g. Cuál es su
densidad?
6. Un trozo irregular de un metal que
tiene una masa de 89,2 g se colocó en una probeta graduada que contenía 25 cm3
de agua. El nivel del agua aumentó hasta un volumen de 34,5 cm3.
Cuál es la densidad del metal?
7. Cuál es la diferencia entre masa y
peso?
8. Establezca diferencias entre mezclas
y compuestos.
9. Clasifica las siguientes sustancias
en: compuestos, mezclas y elementos.
sustancias
|
element
|
Comp.
|
Mez
|
Hierro
|
|||
Leche
|
|||
Alcohol
|
|||
Cerveza
|
|||
Cobre
|
|||
Azúcar
|
|||
Pan
|
10. Indica si las siguientes acciones
producen fenómenos que corresponden a un cambio físico ó químico.
§ Disolver azúcar en agua
§ Mezclar arena y agua
§ Cocinar un huevo.
§ Quemar un trozo de sodio.
§ Sublimar yodo.
§ Condensar el vapor de agua.
§ Fundir parafina
§ Quemar gasolina.
11. Clasifica los materiales de la lista
en las siguientes categorías: mezclas heterogéneas, mezclas homogéneas,
compuestos y elementos.
Ø Plomo Granito
Ø Agua Concreto
Ø Acero Amoniaco
Ø Mercurio
Ø Cerveza
Ø Bebidas gaseosas
BUEN PULSO Y EXITOS.
---------------------------------------------------------------------------------
TALLER DE QUÍMICA
FUNCIÓN ÁCIDO.
NOMBRE:
____________________________________________________ GRADO: 10
1. El cloro es un gas que fácilmente se combina con el
oxígeno del aire y produce un óxido de cloro; éste al reaccionar con agua forma
el ácido clórico. Plantea, con ecuaciones, las reacciones que se llevan a cabo. (Al final)
2. El nitrógeno reacciona con el oxígeno para formar un
óxido ácido. Éste se combina con agua para producir ácido nítrico. Escribe las
reacciones que se llevan a cabo y nombra
el óxido que participa en estas reacciones. (Al final).
3. Escribe las ecuaciones de formación de los siguientes
ácidos:
a.
H2CO3
b.
HBrO
c.
HMnO4
d.
HIO3
e.
H2S
4. Escribe la fórmula de los ácidos que se obtienen a
partir de cada uno de los siguientes óxidos:
a.
NO2
b.
Br2O5
c.
CO2
d.
Cl2O5
e.
I2O7
5. Escribe los nombres a los siguientes ácidos en el
sistema tradicional:
HClO
|
H2CO3
|
||
HClO3
|
H2Se
|
||
HI
|
HCl
|
||
HBrO
|
HClO4
|
||
H2S
|
H2S
|
||
HF
|
H3PO4
|
||
HBrO3
|
HNO3
|
||
HIO3
|
H2SO3
|
||
HNO2
|
H2SO4
|
||
H2Cr2O7
|
HIO4
|
||
HClO2
|
HMnO4
|
6. Escribe la fórmula de los siguientes ácidos:
Ácido clórico
|
Ácido crómico
|
||
Ácido sulfúrico
|
Ácido selénico
|
||
Ácido clorhídrico
|
Ácido cloroso
|
||
Sulfuro de hidrógeno
|
Yoduro de hidrógeno
|
||
Ácido fosfórico
|
Ácido bromhídrico
|
||
Ácido carbónico
|
Ácido mangánico
|
||
Ácido peryódico
|
Ácido dicrómico
|
||
Ácido sulfuroso
|
Ácido nítrico
|
||
Ácido hipobromoso
|
Ácido perclórico
|
||
Ácido sulfhídrico
|
Ácido yodhídrico
|
||
Ácido fosfónico
(fosforoso)
|
Ácido telúrico
|
||
Ácido permangánico
|
Ácido nitroso
|
LA QUÍMICA,
NUESTRA VIDA, NUESTRO FUTURO.
--------------------------------------------------------------------------------
Web con recursos interactivos.
¡Hola!
Les recomiendo este sitio web: https://constructor.educarex.es/inicio.htmlen donde encontrarán gran cantidad de recursos interactivos para distintas asignaturas, vayan eligiendo opciones en los filtros hasta hallar sobre los temas que les interesan, por ejemplo en química pueden elegir las opciones como figuran en la imagen:
Les recomiendo este sitio web: https://constructor.educarex.es/inicio.htmlen donde encontrarán gran cantidad de recursos interactivos para distintas asignaturas, vayan eligiendo opciones en los filtros hasta hallar sobre los temas que les interesan, por ejemplo en química pueden elegir las opciones como figuran en la imagen:
TALLER DE QUÍMICA.
EJERCICIOS DE FORMULACIÓN Y NOMENCLATURA
11. Nombra las siguientes sales binarias:
Nomenclatura
tradicional
|
Nomenclatura
Stock
|
Nomenclatura
sistemática
|
|
CaF2
|
|||
FeCl2
|
|||
FeCl3
|
|||
PbI2
|
|||
KBr
|
|||
CuBr2
|
|||
CuBr
|
|||
AgI
|
|||
CaCl2
|
|||
FeS
|
|||
Fe2S3
|
|||
CuS
|
12. Formula los siguientes compuestos:
Cloruro de
plomo (II): _____________
Bromuro de
calcio: _____________
Fluoruro de
plata: _____________
Yoduro de
hierro (III): _____________
Bromuro de
manganeso (III): _____________
Cloruro de
cobalto (III): _____________
Dicloruro de
níquel: _____________
13. Nombra los siguientes compuestos:
Fórmula
|
Notación
tradicional
|
Pb(SO4)2
|
|
Hg2SO4
|
|
Fe(NO3)3
|
|
Au2(CO3)3
|
|
Li2SO4
|
|
AlPO4
|
|
HNO3
|
|
CaCO3
|
|
Hg(OH)2
|
|
CuOH
|
|
Ca(OH)2
|
|
NaOH
|
15. Formula los siguientes compuestos:
Nombre
|
Fórmula
|
Sulfato
sódico
|
|
Ácido sulfúrico
|
|
Carbonato
de sodio
|
|
Hidróxido
férrico
|
|
Sulfato cúprico
|
|
Nitrato
de aluminio
|
|
Nitrato
de cobre (I)
|
|
Sulfato
de estaño (IV)
|
|
Fosfato
de calcio
|
TU VIDA NO ES UNA COINCIDENCIA ES UN REFLEJO DE TI.
BUEN PULSO Y ÉXITOS.
-------------------------------------------------------------------------------------------------------------------------
Tabla periódica interactiva.
¡Hola!
Les recomiendo la siguiente web: http://www.apptablaperiodica.com/Pueden acceder a la misma haciendo clic en la imagen. Es una tabla periódica interactiva donde además les explica cómo están formados los átomos, las distintas teorías atómicas, el modelo atómico mecánico cuántico con la configuración electrónica, estructuras de Lewis, etc. Muy completo, claro, con ejemplos, excelente recurso para comprender, aprender y comprobar tus conocimientos sobre la tabla periódica y la estructura atómica. Afianza tus competencias sobre el tema.
-------------------------------------------------------------
Vídeo: Tabla periódica
Comparto con ustedes un vídeo, que explica las generalidades de la tabla periódica.
Además, les coloco una imagen a modo de cuadro sinóptico;

--------------------------------------------------------------------------------------------------------------------------
REPASO ENLACE QUÍMICO
REPASO ENLACE QUÍMICO
DESARROLLA TUS COMPETENCIAS.
1.
Haz una tabla comparativa con las características
del enlace covalente y del enlace iónico teniendo en cuenta lo siguiente:
- ¿Cómo se forma?
- ¿Qué compuestos lo presentan?
- Propiedades de los compuestos con este tipo de
enlace
2.
Definir los siguientes términos:
a.
Enlace químico
b.
Valencia
c.
Regla del octeto
d.
Electronegatividad
3.
Dos compuestos, A y B, tienen las siguientes
propiedades:
Compuesto A
|
Compuesto B
|
|
Estado físico
|
Sólido
|
Sólido
|
Punto de fusión
|
346 ºC
|
1196 ºC
|
Solubilidad en agua
|
Soluble
|
Soluble
|
Conductividad eléctrica en solución
|
No
|
Sí
|
¿Cuál de los dos compuestos será más
posiblemente iónico y porqué?
4.
Con base en los valores de electronegatividad
indicar si los siguientes pares de elementos forman enlaces iónicos o
covalentes (polar o no polar)
N-H
|
Ca-F
|
Br-Cl
|
O-P
|
Cu-O
|
S-O
|
O-Na
|
C-P
|
H-S
|
Ba-N
|
O-H
|
I-I
|
Li-F
|
C-S
|
Cs-Br
|
5.
Utiliza la estructura de Lewis para
representar las moléculas de los siguientes compuestos:
CH4
|
Cl2O
|
SiCl4
|
CO2
|
PCl3
|
HClO3
|
NO
|
PCl3
|
HClO
|
H2CO3
|
Na2SO4
|
NH4Cl
|
6.
En cuál de las siguientes fórmulas hay enlace
covalente coordinado o dativo
AlF3 C2H2 SO2 H3O+
7.
Usando el concepto de valencia para los
elementos S, P y Br predice las fórmulas de los compuestos más simples formados
por estos elementos al combinarse, cada uno, con el hidrógeno
8.
¿Qué tipo de enlace se formará entre las siguientes
parejas de elementos y cuál sería la fórmula del compuesto que se formaría?
P y O
|
N y Ba
|
N y Te
|
F y O
|
9.
Indica si es posible un enlace iónico entre
los siguientes pares de elementos y
esquematiza cada uno
K-N
|
F-Zn
|
F-Na
|
Mg-O
|
Cl-Br
|
K-O
|
K-Ca
|
Cl-Ca
|
Cl-O
|
Na-Ca
|
10.
De los siguientes compuestos, ¿cuáles no
cumplen la ley del octeto? Justifique su
respuesta
PCl5 AlBr3 CCl4
CADA QUIÉN ES EL GERENTE DE SU PROPIA VIDA.
-------------------------------------------------------------Infografía: Compuestos inorgánicos.
¡Hola a todos!
Este sitio web los llevará a una buenísima infografía que explica los distintos tipos de compuestos inorgánicos, sus principales propiedades y aplicaciones. Adelante.
 |
| Contento con las TICs. |
Ir : http://www.educ.ar/sitios/educar/recursos/ver?id=20115&referente=docentes
Buen pulso y éxitos.
--------------------------------------------------------------------------------------------------------------------------
Enlace químico: Una fiesta muy elemental.
!Hola a todos! Trabaja on line.
Todos los elementos invitados a una fiesta acudieron, desde el mas liviano hasta los mas pesados. Al transcurrir la fiesta se empieza a notar elementos entusiasmados a reaccionar con otros para enlazarse, para así formar una familia que sería una molécula o un agregado atómico.
El objetivo del "matrimonio" químico es similar al social; supuesta mente se realiza para acompañarse y alcanzar una estructura mas estable, o sea un estado de menor energía.
Para comprender mejor este tema y verificar como estamos planteando las actividades en clase, les recomiendo
: http://www.iessanfulgencio.org/departamentos/fisicayquimica/enlaces/index.html
: http://www.iessanfulgencio.org/departamentos/fisicayquimica/enlaces/index.html
Lleva tus dudas a clase. Nos vemos allí.
Buen pulso y éxitos.
---------------------------------------------------------------------------------------------------------------------
Fórmulas de compuestos inorgánicos.
Busquen en la página "Formulación y nomenclatura", exploren la misma y de clic en fórmulas químicas. Exploren la misma y selecciona la opción pulsando el botón correspondiente a número de oxidación.
Resuelva la ficha #1 y ficha # 2. Prepárese en casa y adquiera las competencias necesarias respecto al tema. Ánimo. Confío en ustedes.
Este tema es necesario para comprender la nomenclatura química inorgánica.
Tu vida no es una coincidencia, es un reflejo de tí.
--------------------------------------------------------------------------------------------------------------------------
Laboratorio virtual sobre densidad .
¡Hola a todos!
Laboratorio virtual sobre densidad .
¡Hola a todos!
Siga las instrucciones de las distintas simulaciones y realicen las actividades propuestas.
Pueden bajar las hojas de cálculo y/o planillas que aparecen en la misma.
Quedo a la espera de todas las consultas y dudas. ¡A trabajar!
Luego entregue los resultados en la fecha y modalidad indicada en el curso.
Nos vemos en clase.
Busca al mejor, imita y supera.
---------------------------------------------------------------------------------------------------------------------
Taller: El mol y cambio de unidades.
(Mol,gramos, moléculas, litros)
1. Calcula la masa de 4.14xE23 moléculas de oxígeno (O2).
2. Calcula cuántas moléculas contienen 4 gramocloruro de sodio (NaCl).
3. Calcula la masa de 1.5xE23 moléculas de gas carbónico(CO2)
4. Cuántas moles de agua (H2O) contienen 1.48xE23 moléculas de dicha sustancia.
5. Calcula el número de moléculas que contienen 4.3 moles de ácido clorhídrico (HCl)
6. Calcula la masa de 9 litros de oxígeno medido a condiciones normales (C. N)
7. Calcula el volumen a C.N de 2 moles de amoniaco (NH3)
8. Calcula cuántas moles de metano (CH4) hay en 8.5 litros de dicho gas a C.N.
9. Calcula el número de moléculas que contienen 3.5 litros de oxígeno medidos en C.N.
10. Calcula el volumen en C.N que ocupan 130 gramos de Hidrógeno
11. En un recipiente cerrado hay 132 gramos de propano (C3H8)
a. Cuántas moléculas hay?
b. Cuántas moles hay de C3H8?
c. Cuántos átomos de carbono?
12. Dos moles de trióxido de azufre (SO3)
a. Cuántas moléculas contienen?
b. Cuántas átomos de azufre?
Despertando la alegría por el trabajo y el conocimiento.
---------------------------------------------------------------------------------------------------------------
FUNCIÓN SAL.
Ejercicios de aniones y sales oxácidas.
E Empareja cada formula con el de su nombre.
NO3-
|
Ión carbonato
|
BrO2-
|
Ión bromito
|
ClO4-
|
Ión peryodato
|
SO42-
|
Ión perclorato
|
CO32-
|
Ión sulfato
|
NO-
|
Ión nitrato
|
IO4-
|
Ión hiponitrito
|
2. Indica la valencia del no-metal en los siguientes compuestos
NO3-
|
N valencia V
|
SO42-
| |
CO32-
| |
BrO3-
| |
BrO2-
| |
IO4-
| |
ClO4-
| |
SeO32-
| |
FO2-
| |
SnO22-
| |
IO2-
|
3. Completa la siguiente tabla.
Nombre de la sal
|
catión
|
oxoanión
|
Fórmula de la sal
|
Sulfito de cesio
|
Cs+
|
SO32-
|
Cs2SO3
|
Sulfito de niquel(II)
|
Ni2+
| ||
Sulfito de aluminio
|
Al3+
| ||
Bromato de litio
| |||
Bromato de berilio
|
BrO3-
| ||
Bromato de hierro(III)
|
Fe(BrO3)3
|
4. Completa la siguiente tabla.
Formula
|
Nombre
|
Sulfato de cromo(III)
| |
Cd3(PO4)2
| |
Nitrato de litio
| |
Al(ClO3)3
| |
Ba(NO3)2
| |
FeCO3
| |
Sulfato de antimonio(III)
| |
Arseniato de cobre(II)
| |
Cr2(SO3)3
| |
Clorato de mercurio(II)
| |
Telurito de plata
| |
Cs2SO3
| |
Sulfito de niquel(II)
| |
Sulfito de aluminio
| |
Bromato de litio
| |
Bromato de berilio
| |
Fe(BrO3)3
| |
Na3PO4
| |
Fosfato de calcio
| |
Co PO4
|
Despertando la alegría por el trabajo y el conocimiento.
-----------------------------------------------------------------------------------------------------------------------
Infografía: Clasificación de la materia.
¿Qué es la materia? ¿Cómo se clasifica? En esta animación te presentamos un cuadro resumen sobre la clasificación de la materia.
Cambiando la forma de actuar y de pensar, podrás obtener mejores resultados académicos. Adelante .......
--------------------------------------------------------------------------------------------------------------------------
Métodos de separación en sistemas homogéneos.
En esta animación te mostramos cuales son las diferencias entre los sistemas materiales que presentan una sola fase, llamados sistemas materiales homogéneos y los sistemas heterogéneos.
También te mostramos porqué es necesario recurrir a métodos diferentes de separación que los utilizados en sistemas heterogéneos.
Revisa la página web y afianza tus conocimientos sobre el tema.
---------------------------------------------------------------------------------------------------------------------
El calor y la temperatura.
Una infografía con imágenes animadas que muestran con ejemplos y esquemas cómo los cambios de temperatura se deben a intercambio de energía. Un recurso para mostrar conceptos complejos y con algún grado de dificultad.
Leva todas tus dudas a clase. Nos vemos allí.
----------------------------------------------------------------------------------
Los números cuánticos y estructura electrónica.
¿A qué se llama configuración electrónica del átomo? ¿Quiénes son los actores principales en las uniones químicas? ¿Cómo se determina la estructura electrónica en un átomo?. Míralo en esta animación.
Revisa el sitio y adquiere las competencias necesarias sobre el átomo.
-------------------------------------------------------------------------------------------------
La materia: una presentación interactiva.
La materia es todo aquello que tiene masa y ocupa un lugar en el espacio. No dilatemos mas la espera, ha llegado el gran momento, entra en esta página y valora el gran trabajo que ha realizado su autor.
Afianza tus conocimientos sobre la materia. A trabajar.
------------------------------------------------------------------------------------------------------------------------
Webquest: La materia, cambios químicos
y cambios físicos.
Es una herramienta alternativa para el aprendizaje de conceptos básicos sobre cambios químicos y físicos de la materia, la cual a través de las problemáticas ambientales, tema que compete a todos con el fin que seas activo y crítico en nuestro entorno y adquieras habilidades como reconocer, analizar, interpretar y proponer alternativas de solución que lleguen beneficiar nuestro entorno.
Ir al enlace: http://webquest.carm.es/majwq/wq/ver/28314
Revisa el sitio e inicia los cambios que salvarán nuestro planeta.
--------------------------------------------------------------------------------------------------------------------------
NÚMEROS CUÁNTICOS.
Ejercicios.
1. Realiza la configuración electrónica para Z = 11, 19, ·37 y explica las propiedades químicas comunes.
2. Haga una lista con los valores de l y m permitidos para un electrón que está en el nivel cuántico n = 3.
3. Escribe la fórmula para calcular el número de electrones de cada subnivel y realiza los cálculos para l = 2 y 3.
4. Completa el siguiente cuadro:
No C
|
Propiedad
|
Valores
| |||||
1º n
|
Niveles
| ||||||
2º l
|
Subniveles
| ||||||
Valores
| |||||||
No máximo de e-
| |||||||
3º m
|
No de orbitales
| ||||||
Valores posibles
| |||||||
5. Cuánto es el número de electrones que poseen los niveles de energía, muestra los cálculos.
a. n=1 b. n = 5 c. n = 7
6. Indique cuál de las siguientes especies tiene más electrones desapareados: S, S-, S+
Para cada caso muestre la distribución de los electrones en sus correspondientes orbitales.
7. Explica que significa apantallamiento de electrones.
8. Escribe el diagrama de Moller y señala con flechas el curso de su lectura.
9. Qué orbital de cada uno de los siguientes pares tiene menor energía en un átomo poli - electrónico:
a. 2s, 2p b. 3p, 3d c. 3s, 4s d. 4d, 5f
10. Escribe la fórmula que te permite calcular el número de orbitales. Calcula el número de orbitales para s, p, d, f.
11. Para n = 3 ¿Cuáles son los valores posibles de números cuánticos l.
Para l = 3 ¿Cuáles son los valores posibles de n?
12.Dé los valores de n, l y m para:
a. Cada orbital en la subcapa 4f
b. Cada orbital en la capa n = 2.
13. Realiza la configuración electrónica para los elementos: Z = 17; Z =26
Distribuye los valores de valencia de cada uno de los anteriores elementos e indica cuál posee la propiedad Paramagnética y cuál Diamagnética.
14. Define el concepto de orbital. Describe las características de un orbital s y p. Dibuja los orbitales s y p.
15. Escribe una lista con todos los subniveles, y orbitales conocidos, con el número cuántico principal n, cuando n = 4.
16. Para cada uno de los siguientes subniveles, proporcione todos los valores de los números cuánticos (n, l y m) y el número de orbitales de cada subnivel: 4p, 3d, 3s y 5f.
17. Si un electrón se encuentra en el subnivel 4f y el otro en el 6s. Cuál es más energético?
E = n + l
18. La configuración electrónica de cierto átomo neutro es 1S2 2S2 2P6 3S2
Escriba el conjunto completo de los números cuánticos para cada uno de los electrones del último nivel.
19.Cuál es la utilidad de los siguientes números cuánticos:
a. n -------
b. l --------
c. m -------
d. ms -------
-------------------------------------------------------------------------------------------
Escala de pH (potencial de hidrógeno)
skoool (TM) Lección. Escala de PH
Hagan clic en el vínculo anterior o en la imagen para saber qué es la escala de pH.








No hay comentarios:
Publicar un comentario